新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 东南亚医械注册医械注册怎么做?新马泰印菲准入一篇文章帮您总结

2024-08-30
全球医疗行业的快速发展,东南亚地区的医疗器材市场也日益壮大。然而,对于想要进入这个市场的医疗器械生产商来说,了解如何进行注册和准入是非常重要的。本文将为您揭示东南亚医械注册的具体步骤和注意事项,让您更好地适应这个充满机遇与挑战的市场。
实际上,不管是哪个国家,医疗器械准入都能简单的分为几个步骤:分类、授权代表、提交技术文件审核、完成注册销售。
我们按照注册流程为大家整理,干货满满,大家记得收藏!
一、新加坡Singapore
1. 确定分类
新加坡是东南亚国家联盟(ASEAN)的成员,因此,其监管体系的许多要素与东盟医疗器械指令(AMDD)相协调。
医疗器械和体外诊断产品在新加坡由卫生科学管理局(HSA)管理,体外诊断产品作为医疗器械的一个子集受到监管,并共享相同的分类系统。
根据HSA指导文件GN-13(医疗器械)和GN-14(IVD)确定器械的分类:
2. 新加坡注册人
指定一个新加坡注册人来协调并向HSA提交器械注册申请
3. 技术文件提交与审核
- 当医疗器械已经在澳大利亚、加拿大、欧洲、日本或美国这些参考市场获得批准并销售时,这些器械在新加坡的注册流程将被大大简化。
- 注册人应使用东盟通用提交档案模板(CSDT)或国际医疗器械监管机构论坛(IMDRF)的目录(ToC)格式来准备提交档案。所有申请必须通过医疗器械信息和通信系统(MEDICS)以电子方式提交。这包括提交所有必要的技术文件、质量管理体系证明以及支付相关的注册费用。
- 对于A类医疗器械,注册过程相对简单。有许可证的进口商可以直接在其许可证下列出A类设备,而无需经过详细的评估。HSA会在A类医疗器械数据库中发布这些器械,表明它们已被注册。
- 对于风险较高的B、C、D类医疗器械,HSA会进行更详细的分类验证和应用评估。一旦器械通过评估,HSA将颁发注册,并在新加坡医疗器械注册(SMDR)中列出这些器械,表明它们已被正式批准在新加坡销售和使用。
4. 完成注册
完成注册,开始销售您的产品。
二、马来西亚Malaysia
1. 确定分类
进入马来西亚医疗器械市场的外国制造商可以通过利用其在认可的参考市场——澳大利亚、加拿大、欧洲、日本或美国的现有批准来简化注册流程。
制造商应遵循马来西亚医疗器械管理局(MDA)发布的指导文件,包括《2012年医疗器械法规附表1》、《通用医疗器械分类规则指南》(MDA/GD/0009)和《体外诊断(IVD)医疗器械分类系统》(MDA/GD/0001),分为以下几类:

2. 马来西亚授权代表
对于在马来西亚没有本地业务的外国医疗器械制造商,指定一位马来西亚授权代表(AR)是进入该国市场的一个关键步骤。
3. 技术文件提交与审核
- 在马来西亚,对于B、C、D类医疗器械,制造商需要将技术文件提交给认可的合格评定机构(CAB)进行技术评审验证。
- 技术文件的准备应遵循东南亚国家联盟(ASEAN)通用提交档案模板(CSDT)格式,CSDT格式通常包括ISO证书、标签、CE证书等,CAB收到技术文件后,将对这些文件进行详细的技术评审,如果CAB认为文件满足所有要求,就会颁发一份技术评审证书。
- 在CAB审核通过后,马来西亚AR通过MDA医疗器械集中在线系统(MeDC@St2.0)以电子方式提交最终的注册申请。
- MDA收到申请后,会进行全面的评估。
- 如果MDA批准了申请,它将颁发注册证书,并分配一个唯一的注册号。注册证书的有效期通常为5年。
4. 完成注册
马来西亚AR必须签发授权书,允许您的进口商和/或分销商为您的设备执行这些功能,之后可以开始销售您的产品了。
三、泰国Thailand
1. 确定分类
在泰国,医疗器械和体外诊断(IVD)设备的监管由泰国食品和药物管理局(泰国FDA)的医疗器械控制部门(MDCD)负责。泰国的医疗器械监管框架主要依据以下法律法规:
B.E.2551医疗器械法案(公元2008年)
B.E.2562医疗器械法案(第二版,公元2019年)
泰国的医疗器械分类规则基于东南亚国家联盟(东盟)医疗器械指令(AMDD),制造商也可以向MDCD提交产品信息,以确认设备的分类。
2. 泰国授权代表
指定一名泰国授权代表代表你提交申请。
3. 技术文件提交与审核
3. 技术文件提交与审核
- 1类设备:
通常属于简单的医疗器械,它们不需要复杂的文件和技术评审。对于这类设备,只需要准备一份简单的清单和一个简单的应用程序即可。这些文件可以是英文的,不需要通过泰国FDA的电子提交系统在线提交。
- 2、3、4类设备:
需要更全面的技术文件和详细的文件目录,包括设备标签、包装说明书、国家特定文件、授权书和符合性声明。此外,还需要质量管理体系(QMS)证书。所有这些文件都必须是英文的,并且通过泰国FDA的电子提交系统在线提交。
- 国内代表负责准备和提交所有必要的文件,并通过泰国FDA的电子提交系统在线提交申请。提交后MDCD会检查应用程序的完整性。
- 如果申请被接受,泰国FDA将进行进一步的审查。
- 全部审查后申请人需要支付申请费和审批费。
- 申请完成后,1类产品会发布产品清单。对于2、3类设备,泰国FDA会发布产品通知。对于4类设备,泰国FDA会发放注册许可。
4. 完成注册
开始在泰国营销您的设备,并保持上市后的责任。
四、印尼Indonesia
1. 确定分类
在印度尼西亚,医疗器械和体外诊断设备(IVD)的分销许可分类是根据《医疗器械分销许可分类指南》来确定的。
印度尼西亚是东南亚国家(东盟)协会的成员,因此,已经协调了许多要素的监管体系与东盟医疗器械指令(AMDD)。所有医疗器械和IVDs必须在药品和医疗器械总局注册后才能投放印尼市场。一旦注册,市场授权将以分销许可证的形式发放。

2. 独家代理/分销商
在印度尼西亚,如果外国制造商没有在当地设立业务实体,需指定具有卫生部有效许可的独家代理/分销商(PAK)。PAK有助于您的器械注册,并充当外国制造商和总局之间的联络人。
3. 技术文件提交与审核
医疗器械和体外诊断设备的注册流程遵循东盟共同提交档案模板(CSDT)的要求:
- 根据CSDT的要求准备注册提交档案。
- PAK将完整的注册提交档案上传至印度尼西亚药品和医疗器械总局的在线注册系统。
- PAK对生成的账单代码完成在线注册费用支付。
- 确认付款后印度尼西亚药品和医疗器械总局将开始对提交的注册档案进行技术评价和审查。
- 审核结束总局将向申请人发送分销许可证草案。
- 确认后总局将最终确定许可证,并发放正式的分销许可证。许可证的有效期通常为5年。
4. 完成注册
您现在可以开始在印度尼西亚销售您的设备。
五、菲律宾Philippine
1. 确定分类
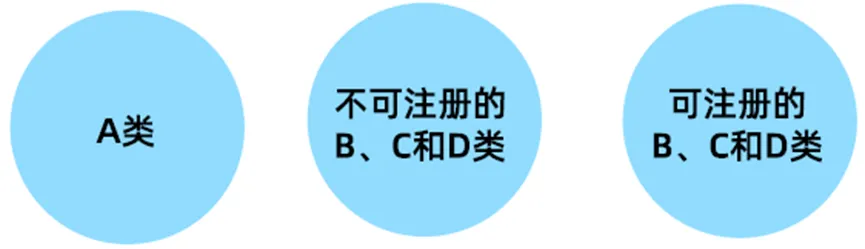
菲律宾的医疗器械监管由菲律宾食品和药物管理局(FDA)负责,该机构依据东南亚国家联盟(ASEAN)医疗器械指令(AMDD)1附录2中建立的分类规则来确定医疗器械的风险分类。根据AMDD的分类标准,医疗器械被分为A、B、C和D四类。
A类医疗器械属于低风险,不需要特别的监管措施。这类器械需要获得医疗器械通知证书(CMDN)以证明其安全性和有效性。
B、C、D类医疗器械属于中风险和高风险医疗器械,需要更加严格的监管。对于B类、C类和D类医疗器械,如果被判定为“可注册”,则需要获得医疗器械注册证书(CMDR)。如果判定为“不可注册”,则会受到FDA通告2021-002-C.2中概述的过渡性规定约束。
2. 菲律宾当地代表
指定一名持有FDA颁发的有效经营许可证(LTO)的当地代表(进口商)。
3. 技术文件提交与审核
在菲律宾,医疗器械的注册流程遵循行政令(AO)2018-0002的指导,根据器械的不同风险分类,申请者需要准备相应的技术文件并提交给菲律宾食品和药物管理局(FDA)。
- 准备申请文件
A类器械:根据AO 2018-0002的附件A要求,准备申请的法律文件。然后,根据附件B的要求准备CMDN申请的技术文件。
不可注册的B、C和D类器械:同样,根据AO 2018-0002的附件B准备CMDN申请的技术文件。
可注册的B、C和D类器械:根据AO 2018-0002的附录C(B类)、附录D(C类)或附录E(D类)准备CMDR申请的技术文件。
- 提交与费用支付:进口商或独家代理/分销商提交CMDN或CMDR申请,并支付相应的费用。
- 菲律宾FDA审查提交的申请和技术文件,确保所有信息的完整性和合规性。
- A类器械:在积极审查后,FDA将颁发CMDN。CMDN的有效期为5年。
- 不可注册的B、C和D类器械:在积极审查后,FDA将颁发过渡性CMDN。过渡性CMDN的有效期为2年。在2年过渡期结束后,为了继续在菲律宾市场销售,需要申请CMDR。
- 可注册的B、C和D类器械:在积极审查后,FDA将颁发CMDR。CMDR的有效期同样为5年。
4. 完成注册
现在可以开始销售您的产品了。
总的来说,东南亚医械注册的过程并不繁琐,只要您按照规定的步骤进行,并注意一些细节问题,就能够顺利地完成注册并进入这个充满潜力的市场。
希望这篇文章能够帮助到您,让您的医疗器械能够在东南亚地区顺利上市,实现商业价值的最大化。大家还有什么想看的国家欢迎留言!
End
获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!



