新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说丨新加坡医疗器械准入攻略

2023-07-13
原文网址:https://mp.weixin.qq.com/s/L7syOuWByoC7p0q1YhVacQ

新加坡作为一个高度发达的国家,医疗保健市场近年来呈现高速增长趋势。
在新加坡医疗器械包含一般医疗器械和体外诊断医疗器械,也就是说IVD产品在新加坡是作为医疗器械的一个子级,统一管理的,
这个管理的部门叫HSA,全称是health Sciences authority。
新加坡医疗器械主要框架:

当确定了产品属于医疗器械后,我们要判断产品在新加坡的分类等级,在新加坡产品根据安全风险高低,分为ABCD四个等级,A类风险最低,D类
风险最高,每一类产品的监管方式也有区别。

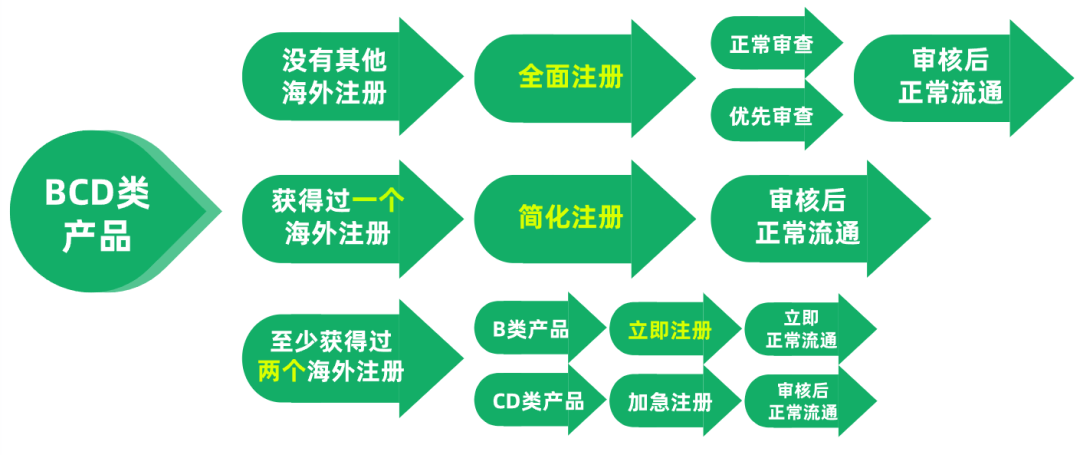
BCD类的产品需要在新加坡进行注册,根据是否获得过其他国家和地区的注册,比如澳大利亚TGA、加拿大HC、美国FDA、欧盟CE、日本MHLW注册
全面审核注册可以申请优先审查,优先审查可以理解为在全面审核中的加速,当产品是属于新加坡的重点医疗保健领域时就可以申请加速,这些领
域包括:癌症、糖尿病、眼科、心血管、传染病或其他领域特别突出新颖的治疗手段。
当产品至少获得过两个海外注册时,另类产品可申请立即注册,也就是在提交申请后,HSA立即通过审核,产品立即取得HSA的注册。C类和D类产
品虽然不能立即注册,可申请加急注册,HSA的审核周期又将大大缩短除了以上常规注册,还有一些特殊情况,比如C类的独立医疗应用软件,当
获得一个海外注册时,就可以申请立即注册。

End
获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!
![]()
联系我们