新闻动态

新捷报,捷闻报 了解最新捷闻咨询
双语读法规丨2020版IEC 62366-1中的”术语和定义”

2022-06-02
原文网址:https://mp.weixin.qq.com/s/1F3dvQkR_bTMhzD1-Gj0lA

可用性工程也叫人因工程。可用性工程专注于用户界面的设计,它让人们能够快速理解如何以最有效和无错误的方式来使用产品。可用性工程也是医疗器械行业的一个重点。缺乏
直观设计和未能考虑到用户与医疗器械的交互可能会危及患者和用户的安全。
我们先来了解IEC 62366-1:2015/AMD 1:2020标准中的一些重要定义:
注:可用性包括有效性、效率和用户满意度等方面,均可提高或降低安全。
2. 可用性工程(usability engineering)
人因工程(human factors engineering)
对人类行为、能力、局限性和其他特性知识的应用来设计医疗器械(包括软件)、系统、任务,以获得足够的可用性。
注:实现足够的可用性可引起与使用有关的可接受风险。
3. 可用性工程文档(usability engineering file):可用性工程过程产生的一组记录和其他文件。
 IEC 62366-1:2015/AMD 1:2020明确说明:可用性工程文档可以是风险管理文档的一部分。可用性工程文档不要求可用性工程文档独立于风险管理文档保存。可用性工程文档不需要具体包含可用性工程活动形成的所有记录和其他文件。然而其至少宜包含所有需要的文件的引用或索引。
IEC 62366-1:2015/AMD 1:2020明确说明:可用性工程文档可以是风险管理文档的一部分。可用性工程文档不要求可用性工程文档独立于风险管理文档保存。可用性工程文档不需要具体包含可用性工程活动形成的所有记录和其他文件。然而其至少宜包含所有需要的文件的引用或索引。
4. 可用性测试(usability test):在指定的预期使用环境中,探索或评估预期用户的用户接口的方法。
5. 非正常使用(abnormal use):医疗器械的责任方或用户有意识的、故意的行为或故意不作为,其行为结果超出制造商所有合理的风险控制措施。
例如:使用粗心、破坏或故意无视安全的信息的行为。
非正常使用示例:医生用手术刀当水果刀使用
注1:刻意的错误行为不是非正常使用,而是一种使用错误。非正常使用并不能解除制造商对非用户接口相关的风险控制的考虑。
6. 正常使用(normal use):按照使用说明书操作(包括用户的日常检查和调整)和准备,或者对那些没有提供使用说明书的医疗器械按照通常可接受的惯例操作和准备。
注1:正常使用不应与预期使用混淆。虽然这两者都包括制造商对使用的概念,但预期使用的重点在于医疗使用,而正常使用不仅包括医疗使用,还包括维护、运输等。
注2:使用错误有可能在正常使用中发生。
注3:对于无需使用说明书即可安全使用的医疗器械,由某些管辖区监管机构豁免使用说明书。
7. 正确使用(correct use):没有使用错误的正常使用。
注:如果导致与制造商意图或用户期望不同的医疗器械响应,则与使用说明书的偏差仅被视为使用错误。
8. 使用错误(use error):由于一个行为或行为的疏忽而造成不同于制造商预期或用户预期的医疗器械响应。
注1:使用错误包括用户无法完成任务。
注2:使用错误可能是由用户、用户接口、任务或使用环境的特性不匹配造成的。
注3:用户可能意识到或意识不到发生了使用错误。
注4:患者非预期的生理反应本身不被视为使用错误。
注5:导致意外结果的医疗器械的故障不被视为使用错误
使用错误示例:用户将血压计的数据读错,误以为血压很高,结果大量服用降压药。
 非正常使用、正常使用、正确使用、使用错误之间的关系:
非正常使用、正常使用、正确使用、使用错误之间的关系: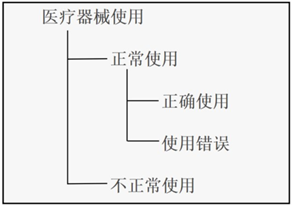
9. 有效性(efficiency):对用户实现特定目标的准确性和完整性的度量。
注:这是不同于“临床有效性”的概念。
10. 形成性评估(formative evaluation):用户接口评价旨在探索用户接口设计的优点、弱点和意外的使用错误。
注:通常在整个设计和开发过程中迭代地进行形成性评价,必要时,在总结性评价之前指导用户接口设计。
 形成性评估是在器械设计和开发阶段进行的。形成性评估用于解决初始风险分析中出现的安全问题,或在最终确定用户接口之前探索不同的设计方案。有可能会进行多次形成性评估。
形成性评估是在器械设计和开发阶段进行的。形成性评估用于解决初始风险分析中出现的安全问题,或在最终确定用户接口之前探索不同的设计方案。有可能会进行多次形成性评估。
11. 总结性评价(summative evaluation):用户接口评价在用户接口开发结束时进行,旨在获得用户接口可安全使用的客观证据。
注:总结性评价涉及验证用户接口的安全使用
 总结性评估在器械的设计验证阶段进行的。总结性评估比形成性评估要严格得多,因为它要证明用户接口对用户来说是安全的。该阶段的测试模拟器械最终用户在现实使用
总结性评估在器械的设计验证阶段进行的。总结性评估比形成性评估要严格得多,因为它要证明用户接口对用户来说是安全的。该阶段的测试模拟器械最终用户在现实使用
环境中进行的可用性测试。
12. 用户接口(user interface):用户与医疗器械交互的方式。
注1:随附文件被认为是医疗器械及其用户接口的一部分
注2:用户接口包括用户与之交互的医疗器械的所有元素,包括医疗器械的物理方面以及视觉、听觉和触觉显示,并不限于软件接口。
注3:为了本标准的目的,医疗器械的系统可被视为单个用户接口
用户接口包括但不局限于:
13. 用户接口评价(user interface evaluation):制造商探索或评估用户与用户接口的交互过程。
注1:用户接口评价可包括以下一种或多种技术:可用性测试、专家评论、启发式分析、设计审核或认知走查。
注2:用户接口评价在整个设计和开发过程中经常进行迭代(这是形成性评价)。
注3:用户接口评价是验证和确认整个医疗器械设计(这是总结性评价)所涉及的活动的一部分。
14. 用户接口规范(user interface specification):收集全面的和前瞻性的描述医疗器械用户接口的规范。
15. 用户特征(user profile):与其用户组的心理、身体和人口统计学特性以及任何特性,如知识、技能和能力等,可以承担设计决策的特性。




