新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 规避风险!您的出口产品责任保险到位了吗?

2023-12-22
原文网址:https://mp.weixin.qq.com/s/VMbURUhg_xJ1ql9fIMzyvA


根据欧盟MDR法规第31条:
In view of the fact that natural or legal persons can claim compensation for damage caused by a defective device in accordance with applicable Union and national law, it is appropriate to require manufacturers to have measures in place to provide sufficient financial coverage in respect of their potential liability under Council Directive 85/374/EEC. Such measures should be proportionate to the risk class, type of device and the size of the enterprise. In this context, it is also appropriate to lay down rules concerning the facilitation, by a competent authority, of the provision of information to persons who may have been injured by a defective device.
译文:
鉴于自然人或法人可根据适用欧盟和国家法律,就缺陷器械造成的损害提出索赔,因此,可要求制造商采取适当措施,就其在第85/374/EEC 号指令规定的潜在责任提供足够的保险范围。这些措施应与器械的风险等级、类型和企业规模成比例。在本文中,还应规定有关主管机构向可能因缺陷器械而受伤人员提供信息的规则。
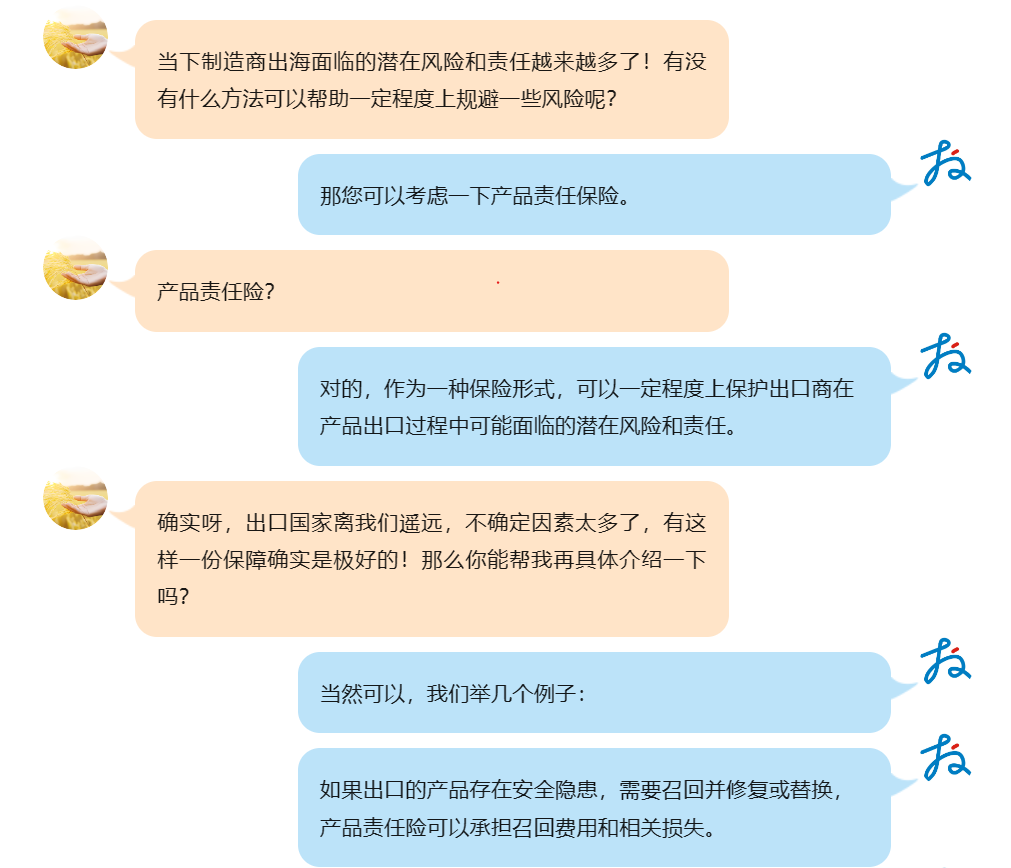
产品责任保险 Product Liability Insurance
在欧盟法规中,供应商是有被要求购买相关出口国家的产品责任保险的义务。但回到现实,其实有很多制造商都忽略了这一点,这对海外销售会带来很大的隐藏风险!
产品责任保险是指以产品制造者、销售者、维修者等的产品责任为承保风险的一种责任保险,而产品责任又以各国的产品责任法律制度为基础。
产品责任险目前国内能承接的保险公司数量较少,而在生命科学领域就更加的少!
很多保险公司没有设置生命科学产品责任险的部门和专人,因此会有无法报价、报价较慢、或者价格偏高的情况。国内大部分保险公司还缺乏海外服务合作机构,因而一旦发生理赔,海外客户理赔服务开展的难度大大加大,造成国内外理赔标和参考法律存在差异、理赔时效慢、服务体验差等不好的体现感。
如何选择有实力的保险合作机构,以下几点可供参考:
1、 有充足的服务网点,服务网点越多,覆盖范围越广,服务越方便越到位;
2、 进口市场要承认,国际化的品牌更容易获得进口市场的认同度;
3、 有跨国理赔案例更佳,因为保险机构的口碑积累来源于理赔事故发生后的事件。
为生产商提供快捷、精准、系统的产品责任险合作商,能大大减少了生产商由于对产品责任险领域的不清晰,导致找不到保险公司、找到保险公司却来回折腾不承接、保险公司报价偏高、找了保险公司却海外后续服务对接不了的情况,不仅影响了产品责任保障的时效,更会影响忠实用户的服务体验。
捷闻国际代表组目前能提供全球十多个主要国家和地区的国际代表服务。同时,我们拥有独立产品责任险对接渠道,整合了产品责任险在生命科学领域的国内的有限综合资源,为您的医疗器械产品出海保驾护航!如果您有相关需求,欢迎随时联系我们!
End
![]()
联系我们