新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻动态 | 聚焦IVD:“扬帆出海,多国准入”研讨会成功举办

2023-07-28
原文网址:https://mp.weixin.qq.com/s/P3EoLJiIImwwcb478ZqXTw

7月26日,捷闻携手广州市黄埔区医疗器械行业协会成功举办IVD研讨会。本期研讨会的主题为“扬帆出海,多国准入”,旨在聚焦IVD行业的大环
境,为IVD产品的多个方面提出新思考。
来自捷闻和协会的相关负责人,与受到邀请的50多位IVD企业代表相聚在广州,就IVD产品,在临床案例、性能分析、多国市场准入等多方面进行了深入交流。

捷闻(Share Info),是一家拥有专业的医疗器械商务、技术服务团队,以助推国内国外医疗器械制造商高效快速地实现法规合规性并取得区域市
场准入为使命的一站式咨询服务商。
广州市黄埔区医疗器械行业协会,是由广州市黄埔区从事医疗器械研发、生产、经营的企业法人自愿组成的行业性的非营利性社会团体法人。
协会现有会员企业133家,涵盖研发、生产、检测、经营及咨询服务企业和临床机构等。协会旨在落实产业发展政策,助力粤港澳大湾区医疗
器械产业高质量发展。
此次活动在大主题扬帆出海,多国准入”下,围绕着中国与国际的IVD注册、临床新形势展开讨论,对IVD产品的性能分析等方面也展开了深度交
流,助力企业发展、加强行业间的交流与合作。





研讨会上,来自捷闻的多位相关负责人,就以下出题开展演讲及讨论:
• IVD产品的欧盟注册(IVDR)
• IVD产品的多国注册
• IVD产品的临床试验
• IVDR分析性能要求

本期,捷闻也为没到现场的朋友们简单总结了当下热点:IVDR过渡期相关部分干货供大家查阅。
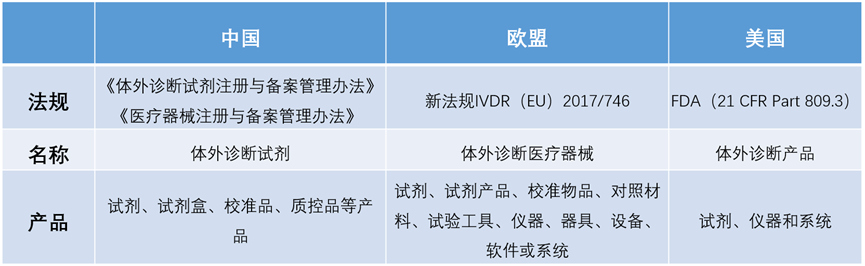
我们先对主要国家地区中美欧的法规现状做个总结:
而欧盟由于正处在法规交替的过渡期,也是目前大家比较关注的,首先我们再次明确过渡期时间线,将情况分为3种,大家可以对号入座。
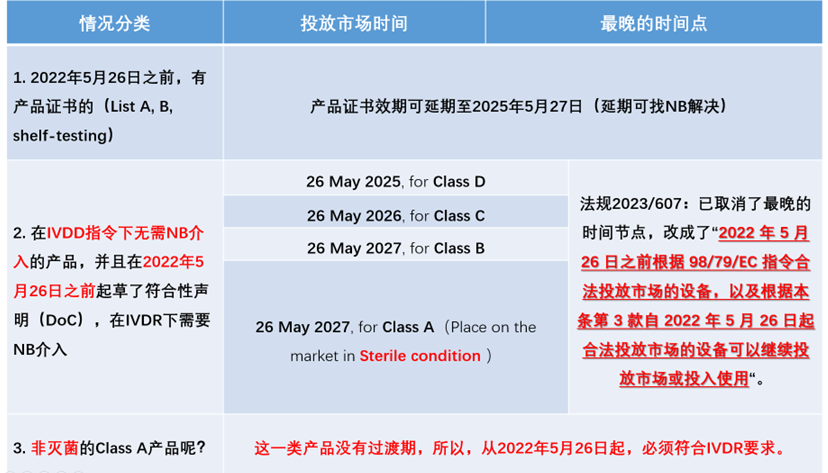
请大家思考:如何能在2022年5月26日之后,IVD产品还能在规定的时间期限内继续以满足IVDD指令的形式投放市场?
答案是:继续符合IVDD指令,并且设计和预期用途没有重大的变化的前提下。
构成变更的情况有两个要素:
一是设计和预期用途方面的变更,二是该变更是非重大变更
如果变更与设计或预期用途无关,则不在IVDR Article 110(3)的范围之内;
如果变更与设计或预期用途有关,且是重大变更,则适用于IVDR Article110(3)的范围之内;
那么在当前这个时间节点,作为制造商,我们能做什么呢?
1. 提供变更的证据是制造商的责任;
2. 制造商有能力去判定变更类型;
3. 制造商应保留变更判定记录,当主管当局索要的时候能提供此类证据;
4. 技术文档的更新。
End
如果各位朋友对本期分享会的其他内容感兴趣,欢迎联系我们的工作人员!
![]()
联系我们