新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 美国EUA篇-中欧美“新冠抗原试剂盒”临床要求差异对比

2022-04-08

据FDA官网4月6日最新消息,厦门波生生物拿下第6个中国相关的美国新冠抗原EUA。这是继相达生物,艾康生物,东方生物,九安医疗、库尔科技之后,第6家获证的中国相关企业。
我们前面分别解读了欧盟和中国对新冠抗原检测试剂盒的临床要求,可点击下方链接,回顾下中国、欧盟的要求。
今天,我们进行最终篇——新冠抗原自测试剂盒FDA EUA临床要求!
新冠抗原自测(ST)试剂盒FDA EUA临床要求
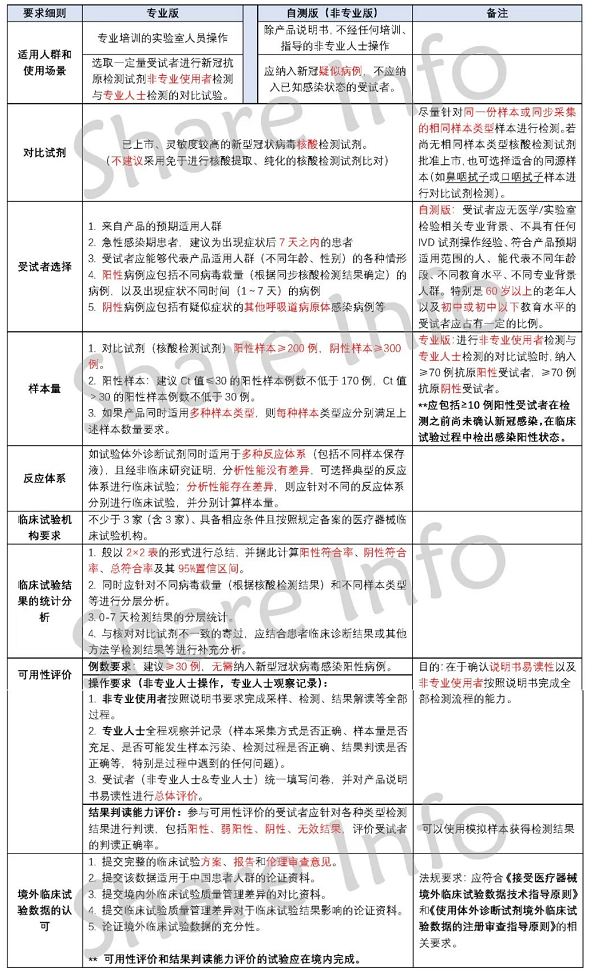
中、欧、美的新冠抗原自测试剂盒临床要求,我们已经分别解读。但随着新的变异毒株来袭,临床要求也不可避免随之变化。比如欧盟MDCG 2021-21,目前已经升级为MDCG 2021-21 Rev.1。
新冠病毒不可避免会在未来较长一段时间存在,新冠在,检测需求就在。如果想要长期在新冠市场中前行,我们还是建议尽早开启临床。新的临床要求出来后,再做补充的差异性试验可能会剩下很多的时间成本。
关于新冠检测试剂的国际注册,包括澳大利亚、欧盟、美国、加拿大、中国、新加坡、新西兰、马来西亚、泰国等,欢迎随时联系捷闻。



