新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 关于医疗器械制造商的投诉处理,您了解多少?

2022-08-04
首先是关于“投诉”的定义
我们可以参考ISO 13485中对投诉的定义:宣传已从组织的控制中放行的医疗器械存在与标识、质量、耐用性、可靠性、可用性、安全或性能有关的缺陷或宣称影响这些医疗器械性能的服务存在不足的书面、电子或口头的沟通。
美国FDA也在法规中提供了对投诉的精确定义:任何书面、电子或口头通讯声称设备在发布出现的关于标识、质量、耐用性、可靠性、安全性、有效性或性能相关的缺陷。( 21 CFR 803 (b) 节)
一般来说,从客户的投诉需求中,我们可以提取到一些具体信息,主要包括:
1. 投诉时间;
2. 投诉地点;
3. 对投诉事件的详细描述,或对故障或潜在故障的描述等;
4. 所涉及的医疗器械信息;
5. 相关参与人员的信息,对患者、使用者或任何其他相关人员造成的后果,以及产生后果后是否进行了医疗干预等情况说明。
投诉处理的流程可概括为以下
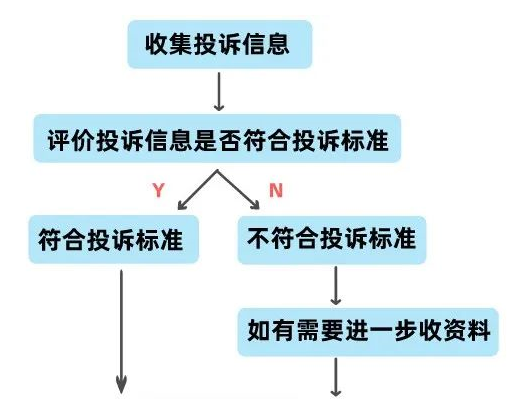
其中我们重点对一些环节做简短解释
● 技术调查
在投诉处理的情况下,技术调查可能会因事件类型和潜在故障类型而大不相同。一般来说,技术调查需要包含以下项目:
1. 事件的根本原因。
如果事件与设备的特定故障、使用错误或任何其他原因有关,则需要对具体投诉涉及的样本进行评估,样本分析的结果应在投诉记录中明确记录。
2. 审查事件中涉及的设备记录。
主要包括:检查设备制造文档中是否涉及诱发事件的可能性,以及检查与事件相关的同一时期制造的设备历史记录(例如之前和之后的批号或序列号)。
3. 统计设备投诉历史记录
通常需要概述在特定时间范围内收到了多少类似事件。
4. 事件给患者带来后果以及医学调查情况。(如有)
结果应包括在投诉调查中。通常需要进行医学调查以评估事件的严重性(是否严重受伤),从而进行适当的可报告性评估。
● 风险评价
如果确定了事件的根本原因,就要进行风险评价,以确保风险仍然是可以接受的。
需要提醒的是,上市医疗器械不可能存在不可接受的风险;一旦风险变得不可接受,应实施现场安全纠正措施或现场安全通知。
● 评估实施纠正措施的必要性
一旦确定了根本原因,应对实施纠正措施的必要性进行评估并记录在案。如果没有采取具体措施,则应记录适当的理由。
● 对客户的回应
在下列情况下,应向客户提供收到的投诉摘要和调查结果,主要包括:
1.客户特别需要一个答复
2.主管当局要求制造商提供答复
投诉管理文档
最后捷闻总结了相关投诉处理流程的文档,主要包括:
欧盟警戒系统控制程序
欧盟警戒系统相关的记录文件
顾客投诉处理控制程序
顾客投诉处理相关的记录文件
若您对此有需求或者疑问,欢迎随时联系您的客户经理或者直接后台留言。



